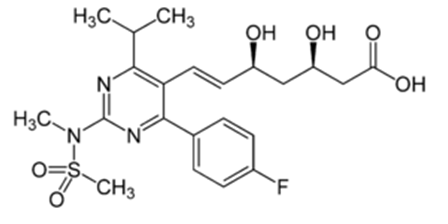
Forma Farmacéutica y Formulación
Forma Farmacéutica
Tabletas
Composición Cualitativa y Cuantitativa
Cada Tableta Recubierta Ruxicol 10 mg contiene
Rosuvastatina…10 mg
(Como Rosuvastatina Cálcica 10.39 mg)
Excipientes c.s.p
Cada Tableta Recubierta Ruxicol 20 mg contiene:
Rosuvastatina…20 mg
(Como Rosuvastatina Cálcica 20.79 mg)
Excipientes c.s.p
Cada Tableta Recubierta Ruxicol 40 mg contiene:
Rosuvastatina…40 mg
(Como Rosuvastatina Cálcica 41.59 mg)
Excipientes c.s.p
DATOS CLÍNICOS
a. Indicaciones terapéuticas
Tratamiento de hipercolesterolemia
Adultos, adolescentes y niños de edad igual o mayor de 6 años con hipercolesterolemia primaria (tipo IIa incluyendo hipercolesterolemia familiar heterocigótica) o dislipidemia mixta (tipo IIb) como medida complementaria a la dieta cuando la respuesta obtenida con la dieta y otros tratamientos no farmacológicos (p. ej.: ejercicio, pérdida de peso) no es la adecuada.
Hipercolesterolemia familiar homocigótica en tratamiento combinado con dieta y otros tratamientos hipolipemiantes (p. ej.: aféresis de LDL) o si dichos tratamientos no son adecuados.
Prevención de Eventos Cardiovasculares
Prevención de eventos cardiovasculares mayores en pacientes considerados de alto riesgo de sufrir un primer evento cardiovascular, como tratamiento adyuvante a la corrección de otros factores de riesgo.
b. Posología y forma de administración
Antes de iniciar el tratamiento, el paciente se debe someter a una dieta estándar para reducir los niveles de colesterol que continuará durante el tratamiento. La dosis debe ser individualizada de acuerdo con el objetivo del tratamiento y la respuesta del paciente empleando las guías de tratamiento actuales.
Rosuvastatina se puede administrar a cualquier hora del día, con o sin alimentos.
Tratamiento del hipercolesterolemia
La dosis inicial recomendada es 5 ó 10 mg vía oral, una vez al día tanto en pacientes que no hayan recibido estatinas como en pacientes que hayan sido tratados previamente con otro inhibidor de la HMG-CoA reductasa. En la elección de la dosis de inicio se debe tener en cuenta el nivel de colesterol del paciente y el posible riesgo cardiovascular, así como el riesgo potencial de reacciones adversas (ver a continuación). Si fuera necesario, tras 4 semanas puede aumentarse la dosis hasta el siguiente nivel de dosis.
Debido al aumento de notificaciones de reacciones adversas con la dosis de 40 mg en comparación con las dosis menores, solamente se considerará un ajuste final a la dosis máxima de 40 mg en pacientes con hipercolesterolemia grave con alto riesgo cardiovascular (especialmente pacientes con hipercolesterolemia familiar) que no alcancen sus objetivos de tratamiento con 20 mg, y en los que se llevará a cabo un seguimiento rutinario.
Se recomienda iniciar la dosis de 40 mg bajo la supervisión de un especialista.
Prevención de eventos cardiovasculares
En el estudio sobre reducción del riesgo de eventos cardiovasculares, la dosis utilizada fue de 20 mg al día.
Población pediátrica
El uso en población pediátrica se debe llevar a cabo por especialistas.
Uso en niños y adolescentes de 6 a 17 años de edad, (estadío <II-V de Tanner)
La dosis de inicio recomendada para niños y adolescentes con hipercolesterolemia familiar heterocigótica, es de 5 mg diarios.
- En niños de 6 a 9 años de edad con hipercolesterolemia familiar heterocigótica, el rango de dosis habitual es de 5 a 10 mg vía oral una vez al día. No se ha estudiado la seguridad y la eficacia de dosis superiores a 10 mg en esta población.
- En niños de 10 a 17 años de edad con hipercolesterolemia familiar heterocigótica, el rango de dosis habitual es de 5 a 20 mg vía oral una vez al día. No se ha estudiado la seguridad y la eficacia de dosis superiores a 20 mg en esta población.
Las dosis se deben individualizar y ajustar de acuerdo con la respuesta y la tolerabilidad de los pacientes pediátricos, como figura en las recomendaciones para tratamiento pediátrico. Los niños y adolescentes se deben someter a una dieta estándar específica para reducir el colesterol antes de iniciar el tratamiento con rosuvastatina; esta dieta se debe mantener durante todo el tratamiento.
La experiencia en niños con hipercolesterolemia familiar homocigótica está limitada a un número pequeño de niños de edades de entre 8 y 17 años.
Los comprimidos de 40 mg no son adecuados para el uso en población pediátrica.
Niños menores de 6 años de edad
No se ha estudiado la seguridad y eficacia del uso en niños menores de 6 años de edad. Por lo tanto, no se recomienda administrar rosuvastatina en niños menores de 6 años de edad.
Pacientes de edad avanzada
En pacientes mayores de 70 años, se recomienda una dosis de inicio de 5 mg). No es necesario ningún otro ajuste de dosis en relación a la edad.
Insuficiencia renal
No es necesario ajustar la dosis en pacientes con insuficiencia renal leve a moderada.
En pacientes con insuficiencia renal moderada (aclaramiento de creatinina <60 ml/min) la dosis de inicio recomendada es de 5 mg. La dosis de 40 mg está contraindicada en pacientes con insuficiencia renal moderada. En pacientes con insuficiencia renal grave el uso de rosuvastatina está contraindicado a cualquier dosis.
Insuficiencia hepática
Rosuvastatina está contraindicado en pacientes con enfermedad hepática activa.
Raza
Se ha observado una exposición sistémica aumentada en pacientes de origen asiático. En pacientes de origen asiático, la dosis de inicio recomendada es de 5 mg. La dosis de 40 mg está contraindicada en estos pacientes.
Polimorfismos genéticos
Se sabe que tipos específicos de polimorfismos genéticos pueden provocar una exposición aumentada a rosuvastatina. En los pacientes que se sabe que presentan estos tipos de polimorfismos, se recomienda una dosis diaria menor de rosuvastatina.
Pacientes con factores de predisposición a la miopatía
En pacientes con factores de predisposición a la miopatía, la dosis de inicio recomendada es de 5 mg.
La dosis de 40 mg está contraindicada en algunos de estos pacientes.
Tratamiento concomitante
Rosuvastatina es un sustrato de varias proteínas transportadoras (por ej.: OATP1B1 y BCRP). El riesgo de miopatía (incluida rabdomiólisis) es mayor cuando rosuvastatina se administra de forma concomitante con algunos medicamentos que aumentan la concentración plasmática de rosuvastatina debido a las interacciones con estas proteínas transportadoras (por ej.: ciclosporina y determinados inhibidores de la proteasa, como combinaciones de ritonavir con atazanavir, lopinavir y/o tipranavir. Siempre que sea posible, se deben considerar medicamentos alternativos, y, si fuese necesario, considerar suspender temporalmente el tratamiento con rosuvastatina. En aquellas situaciones en las que sea inevitable la administración conjunta de estos medicamentos con rosuvastatina, se debe analizar detenidamente el beneficio y el riesgo del tratamiento concomitante y los ajustes posológicos de rosuvastatina.
c. Contraindicaciones
Rosuvastatina está contraindicado:
– En pacientes con hipersensibilidad a rosuvastatina o a alguno de los excipientes.
– En pacientes con enfermedad hepática activa incluyendo elevaciones persistentes, injustificadas de las transaminasas séricas y cualquier aumento de las transaminasas séricas que supere tres veces el límite superior normal (LSN).
– En pacientes con insuficiencia renal grave (aclaramiento de creatinina <30 ml/min).
– En pacientes con miopatía.
– En pacientes en tratamiento concomitante con ciclosporina.
– Durante el embarazo y lactancia y en mujeres en edad fértil que no estén empleando métodos anticonceptivos apropiados.
La dosis de 40 mg está contraindicada en pacientes con factores de predisposición a la miopatía/rabdomiólisis. Dichos factores incluyen:
– Insuficiencia renal moderada (aclaramiento de creatinina <60 ml/min).
– Hipotiroidismo.
– Historial personal o familiar de alteraciones musculares hereditarias.
– Historial previo de toxicidad muscular con otro inhibidor de la HMG-CoA reductasa o fibrato.
– Alcoholismo.
– Situaciones en las que puedan darse aumentos de los niveles plasmáticos.
– Pacientes de origen asiático.
– Uso concomitante de fibratos.
d. Advertencias y precauciones especiales de empleo
Efectos renales
Se ha observado proteinuria, detectada mediante tira reactiva y principalmente de origen tubular, en pacientes tratados con dosis altas de rosuvastatina, en particular 40 mg, en los que fue transitoria o intermitente en la mayoría de los casos. No se ha demostrado que la proteinuria sea indicativa de enfermedad renal aguda o progresiva. La frecuencia de notificación de acontecimientos renales graves en el uso post-comercialización es mayor con la dosis de 40 mg. Se debe considerar realizar una evaluación de la función renal durante el seguimiento rutinario de pacientes que estén siendo tratados con dosis de 40 mg.
Efectos musculoesqueléticos
En pacientes tratados con rosuvastatina se han notificado efectos sobre el músculo esquelético, p. ej.: mialgia, miopatía y, raramente, rabdomiólisis con todas las dosis, especialmente con dosis superiores a 20 mg. Se han registrado casos muy raros de rabdomiólisis con el uso de ezetimiba en combinación con inhibidores de la HMG-CoA reductasa. No se puede descartar una interacción farmacodinámica y se debe tener cuidado con el uso concomitante.
Al igual que con otros inhibidores de la HMG-CoA reductasa, la frecuencia de notificaciones de rabdomiólisis asociada a rosuvastatina durante el uso post-comercialización es mayor con la dosis de 40 mg.
Medida de la Creatina cinasa
No se deben medir los niveles de creatina cinasa (CK) después de la realización de ejercicio intenso o en presencia de una posible causa alternativa del aumento de CK que pueda influir en la interpretación de los resultados. Si los valores iniciales de CK son significativamente elevados (>5xLSN) se deberá realizar de nuevo el ensayo al cabo de 5 a 7 días para confirmar los resultados. Si el nuevo ensayo confirma los valores iniciales de CK >5xLSN, no se debe iniciar el tratamiento.
Antes de iniciar el tratamiento
Al igual que otros inhibidores de la HMG-CoA reductasa, rosuvastatina se debe prescribir con precaución a pacientes con factores de predisposición a rabdomiólisis, tales como:
– Insuficiencia renal.
– Hipotiroidismo.
– Historial personal o familiar de alteraciones musculares hereditarias.
– Historial de toxicidad muscular previa con otro inhibidor de la HMG-CoA reductasa o fibrato.
– Alcoholismo.
– Edad > 70 años.
– Situaciones en las que pueda producirse un aumento de los niveles plasmáticos.
– Uso concomitante de fibratos.
En dichos pacientes el riesgo del tratamiento se debe considerar en relación al posible beneficio del tratamiento y se recomienda la realización de una monitorización clínica. Si los valores iniciales de CK son significativamente elevados (>5xLSN) no se debe iniciar el tratamiento.
Durante el tratamiento
Se debe pedir a los pacientes que comuniquen inmediatamente cualquier dolor muscular, debilidad o calambres injustificados, en particular si están asociados a malestar o fiebre. Se deben medir los niveles de CK en estos pacientes. En el caso de que los niveles de CK sean notablemente elevados (>5xLSN) o si los síntomas musculares son graves y provocan malestar diario (incluso si los niveles de CK son ≤ 5xLSN), debe interrumpirse el tratamiento. Si los síntomas remiten y los niveles de CK vuelven a la normalidad, entonces puede considerarse el re-establecimiento del tratamiento con rosuvastatina o un inhibidor de la HMG-CoA reductasa alternativo a la dosis mínima y bajo una estrecha monitorización. La monitorización rutinaria de los niveles de CK en pacientes asintomáticos no está justificada. Se han notificado para este activo, casos muy raros de una miopatía necrotizante inmunomediada (MNIM) durante o después del tratamiento con estatinas, incluida rosuvastatina. La MNIM se caracteriza clínicamente por una debilidad muscular proximal y unos niveles elevados de creatina cinasa sérica que persisten a pesar de la suspensión del tratamiento con estatinas.
Se ha observado un aumento de la incidencia de miositis y miopatía en pacientes que reciben otros inhibidores de la HMG-CoA reductasa junto con derivados del ácido fíbrico incluido gemfibrozilo, ciclosporina, ácido nicotínico, antifúngicos tipo azol, inhibidores de la proteasa y antibióticos macrólidos. El gemfibrozilo aumenta el riesgo de miopatía cuando se administra de forma concomitante con algunos inhibidores de la HMG-CoA reductasa. Por lo tanto, no se recomienda la combinación de rosuvastatina y gemfibrozilo. El beneficio de alteraciones adicionales en los niveles lipídicos por el uso concomitante de rosuvastatina con fibratos o niacina se debe sopesar cuidadosamente frente a los riesgos potenciales de tales combinaciones. La dosis de 40 mg está contraindicada con el uso concomitante de un fibrato.
Rosuvastatina no se debe co-administrar con formulaciones sistémicas de ácido fusídico o dentro de los 7 días posteriores a la interrupción del tratamiento con ácido fusídico. En pacientes en los que el uso de ácido fusídico sistémico se considera necesario, el tratamiento con estatinas debe interrumpirse durante la duración del tratamiento con ácido fusídico.
Se han notificado casos de rabdomiólisis (incluyendo algunas muertes) en pacientes que estaban recibiendo esta ácido fusídico y estatinas en combinación. Se debe advertir al paciente que acuda inmediatamente a un médico si experimenta síntomas de debilidad muscular, dolor o sensibilidad. El tratamiento con estatinas debe reintroducirse 7 días tras la última dosis de ácido fusídico. En circunstancias excepcionales, cuando es necesario ácido fusídico sistémico de manera prolongada, por ejemplo en el tratamiento de infecciones graves, la necesidad de la co-administración de rosuvastatina y ácido fusídico solamente se debe considerar caso por caso y bajo una estrecha supervisión médica.
No se debe emplear rosuvastatina en pacientes con trastornos agudos graves sugerentes de miopatía o que predispongan al desarrollo de insuficiencia renal secundaria a rabdomiólisis (p. ej.: sepsis, hipotensión, intervención quirúrgica mayor, trauma, trastornos metabólicos, endocrinos o electrolíticos graves o convulsiones no controladas).
Efectos hepáticos
Al igual que otros inhibidores de la HMG-CoA reductasa, rosuvastatina debe usarse con precaución en pacientes que ingieran cantidades excesivas de alcohol y/o presenten un historial de enfermedad hepática.
Se recomienda la realización de pruebas hepáticas antes del inicio del tratamiento y 3 meses después de iniciado el tratamiento con rosuvastatina. Si el nivel de transaminasas séricas sobrepasa 3 veces el límite superior normal se debe interrumpir el tratamiento con rosuvastatina o reducirse la dosis. La frecuencia de notificaciones de acontecimientos hepáticos graves (que consisten principalmente en un aumento de las transaminasas séricas) durante el uso post-comercialización es mayor con la dosis de 40 mg.
En pacientes con hipercolesterolemia secundaria provocada por hipotiroidismo o síndrome nefrótico, la enfermedad subyacente debe ser tratada antes de iniciar el tratamiento con rosuvastatina.
Raza
Los estudios farmacocinéticos muestran un aumento de la exposición en pacientes de origen asiático en comparación con los pacientes caucásicos.
Inhibidores de la proteasa
Se ha observado mayor exposición sistémica a rosuvastatina en pacientes tratados concomitantemente con rosuvastatina y varios inhibidores de la proteasa en combinación con ritonavir. Se debe tener en cuenta tanto el beneficio de la reducción de los lípidos con el uso rosuvastatina en pacientes con VIH que reciben inhibidores de la proteasa, como la posibilidad de que aumenten las concentraciones plasmáticas de rosuvastatina al iniciar y aumentar la dosis de rosuvastatina en pacientes tratados con inhibidores de la proteasa. No se recomienda el uso concomitante con ciertos inhibidores de la proteasa a no ser que se ajuste la dosis de rosuvastatina.
Enfermedad pulmonar intersticial
Se han registrado casos excepcionales de enfermedad pulmonar intersticial con algunas estatinas, especialmente con tratamientos a largo plazo. Los principales signos que se presentan pueden incluir disnea, tos no productiva y deterioro del estado general de salud (fatiga, pérdida de peso y fiebre). Si se sospecha que un paciente ha desarrollado enfermedad pulmonar intersticial, debe interrumpirse el tratamiento con estatinas.
Diabetes Mellitus
Algunas evidencias sugieren que las estatinas como clase, elevan la glucosa en sangre y en algunos pacientes, con alto riesgo de diabetes en un futuro, pueden producir un nivel de hiperglucemia para el cual un cuidado convencional de la diabetes es apropiado. Este riesgo, sin embargo, está compensado con la reducción del riesgo vascular con las estatinas y por tanto no debería ser una razón para abandonar el tratamiento con estatinas. Los pacientes con riesgo (glucosa en ayunas de 5,6 a 6,9 mmol/l, IMC>30kg/m2, triglicéridos elevados, hipertensión) deben ser controlados clínica y bioquímicamente de acuerdo con las directrices nacionales.
Advertencias especiales en relación a los excipientes
Este medicamento contiene lactosa. Los pacientes con intolerancia hereditaria a galactosa, insuficiencia de lactasa de Lapp (insuficiencia observada en ciertas poblaciones de Laponia) o malabsorción de glucosa o galactosa no deben tomar este medicamento. Tener en cuenta en el tratamiento de los pacientes con Diabetes Mellitus.
Potasio: Este medicamento contiene potasio. Debe tenerse en cuenta en pacientes con insuficiencia renal o una dieta baja en potasio.
e. Interacción con otros medicamentos y otras formas de interacción
Efectos de los medicamentos administrados conjuntamente con rosuvastatina
Inhibidores de proteínas transportadoras: rosuvastatina es un sustrato de ciertas proteínas transportadoras, incluyendo el transportador de captación hepática OATP1B1 y el transportador de eflujo BCRP. La administración concomitante de rosuvastatina con inhibidores de estas proteínas transportadoras puede provocar un aumento de las concentraciones plasmáticas de rosuvastatina y aumentar el riesgo de miopatía.
Ciclosporina: durante el tratamiento concomitante con rosuvastatina y ciclosporina, los valores del AUC de rosuvastatina fueron, como media, 7 veces superiores a los observados en individuos sanos (ver Tabla 1). Rosuvastatina está contraindicado en pacientes tratados concomitantemente con ciclosporina. La administración concomitante de rosuvastatina y ciclosporina no afectó a las concentraciones plasmáticas de ciclosporina.
Inhibidores de la proteasa: aunque se desconoce el mecanismo exacto de interacción, el uso concomitante de los inhibidores de la proteasa puede aumentar de manera importante la exposición a rosuvastatina (ver Tabla 1). Se puede considerar el uso concomitante de rosuvastatina y algunas combinaciones de inhibidores de la proteasa tras analizar detenidamente ajustes posológicos de rosuvastatina basados en el aumento esperado de la exposición a rosuvastatina.
Gemfibrozilo y otros medicamentos reductores del colesterol: la administración concomitante de rosuvastatina y gemfibrozilo duplicó la Cmax y el AUC de rosuvastatina.
De acuerdo con los resultados de los estudios de interacción específica no se espera ninguna interacción farmacocinética significativa con fenofibrato, sin embargo, sí puede darse una interacción farmacodinámica. Gemfibrozilo, fenofibrato, otros fibratos y dosis hipolipemiantes (mayores o iguales a 1g/día) de niacina (ácido nicotínico), aumentan el riesgo de miopatía cuando se administran de forma concomitante con inhibidores de la HMG-CoA reductasa, probablemente debido a que pueden provocar miopatía cuando se administran solos. La dosis de 40 mg está contraindicada con el uso concomitante con fibratos. Estos pacientes deben iniciar también el tratamiento con una dosis de 5 mg.
Ezetimiba: el uso concomitante de rosuvastatina 10 mg con 10 mg de ezetimiba provocó un aumento de 1,2 veces en el AUC de rosuvastatina en sujetos hipercolesterolémicos (Tabla 1). No se puede descartar una interacción farmacodinámica, en términos de reacciones adversas, entre rosuvastatina y ezetimiba.
Antiácidos: la administración concomitante de rosuvastatina con una suspensión antiácida a base de hidróxido de aluminio y magnesio, originó una disminución de la concentración plasmática de rosuvastatina de 50% aproximadamente. Este efecto se vio mitigado cuando se administró el antiácido 2 horas después de la administración de rosuvastatina. No se ha establecido la importancia clínica de esta interacción.
Eritromicina: el uso concomitante de rosuvastatina y eritromicina originó una disminución del 20% del AUC y una disminución del 30% de la Cmax de rosuvastatina. Esta interacción puede estar causada por un incremento en la motilidad intestinal provocada por eritromicina.
Citocromo P450: los resultados de los estudios in vitro e in vivo muestran que rosuvastatina no es ni un inhibidor ni un inductor de las isoenzimas del citocromo P450. Además, rosuvastatina es un sustrato con poca afinidad para estas isoenzimas. Por lo tanto, no se esperan interacciones medicamentosas debidas al metabolismo mediado por el citocromo P450. No se han observado interacciones clínicamente importantes entre rosuvastatina y fluconazol (un inhibidor CYP2C9 y CYP3A4) ni ketoconazol (un inhibidor de CYP2A6 y CYP3A4).
Interacciones que precisan ajustes posológicos de rosuvastatina (ver también Tabla 1): Cuando sea necesario administrar rosuvastatina conjuntamente con otros medicamentos conocidos por aumentar la exposición a rosuvastatina, debe ajustarse la dosis de rosuvastatina. Empezar con una dosis de 5 mg de rosuvastatina una vez al día si el aumento esperado de la exposición (AUC) es de aproximadamente el doble o más. La dosis máxima diaria de rosuvastatina se ajustará de modo que no sea probable que la exposición prevista a rosuvastatina sea mayor que la de una dosis diaria de 40 mg de rosuvastatina tomada sin medicamentos que interaccionen, por ejemplo, una dosis de 20 mg de rosuvastatina con gemfibrozilo (aumento de 1,9 veces) y una dosis de 10 mg de rosuvastatina en combinación con atazanavir/ritonavir (aumento de 3,1 veces).
Tabla 1. Efecto de los medicamentos administrados conjuntamente sobre la exposición a rosuvastatina (AUC; con objeto de disminuir la magnitud) en los ensayos clínicos publicados.
| Posología del medicamento con el que interacciona | Posología de Rosuvastatina | Variación de AUC de rosuvastatina* |
| Ciclosporina 75mg a 200mg, 2 veces al día, 6 meses | 10mg una vez al día, 10 días | 7,1 veces ↑ |
| Atazanavir 300mg/ritonavir 100mg una vez al día, 8 días | 10mg, dosis única | 3,1 veces ↑ |
| Simeprevir 150mg una vez al día, 7 días | 10mg, dosis única | 2,8 veces ↑ |
| Lopinavir 400mg/ritonavir 100mg dos veces al día, 17 días. | 20 mg una vez al día, 7 días | 2,1 veces ↑ |
| Clopidogrel 300mg de carga, seguidos por 75mg a las 24 horas | 20mg, dosis única | 2 veces ↑ |
| Gemfibrozilo 600mg dos veces al día, 7 días | 80mg, dosis única | 1,9 veces ↑ |
| Eltrombopag 75mg una vez al día, 5 días | 10mg, dosis única | 1,6 veces ↑ |
| Darunavir 600mg/ritonavir 100mg dos veces al día, 7 días | 10mg una vez al día, 7 días | 1,5 veces ↑ |
| Tipranavir 500mg/ritonavir 200mg dos veces al día, 11 días | 10mg, dosis única | 1,4 veces ↑ |
| Dronedarona 400mg dos veces al día | No disponible | 1,4 veces ↑ |
| Itraconazol 200mg una vez al día, 5 días | 10mg, dosis única | **1,4 veces ↑ |
| Ezetimiba 10mg una vez al día, 14 días | 10mg, una vez al día, 14 días | **1,2 veces ↑ |
| Fosamprenavir 700mg/ritonavir 100mg dos veces al día, 8 días | 10mg, dosis única | ↔ |
| Aleglitazar 0.3mg, 7 días | 40mg, 7 días | ↔ |
| Silimarina 140mg tres veces al día, 5 días | 10mg, dosis única | ↔ |
| Fenofibrato 67mg tres veces al día, 7 días | 10mg, 7 días | ↔ |
| Rifampicina 450mg una vez al día, 7 días | 20mg, dosis única | ↔ |
| Ketoconazol 200mg dos veces al día, 7 días | 80mg, dosis única | ↔ |
| Fluconazol 200mg una vez al día, 11 días | 80mg, dosis única | ↔ |
| Eritromicina 500mg cuatro veces al día, 7 días | 80mg, dosis única | 20% ↓ |
| Baicalina 50mg tres veces al día, 14 días | 20mg, dosis única | 47% ↓ |
| *Los datos que se presentan como na variación de x veces representan una relación simple entre la administración conjunta y rosuvastatina en monoterapia. Los datos que se presentan como % de variación representan el % de diferencia respecto a rosuvastatina en monoterapia. El aumento se indica como” ↑ “, sin cambios como “↔”, disminución como “↓”. ** Se ha realizado varios estudios de interacción con diferentes posologías de rosuvastatina, la tabla muestra la relación más significativa. |
||
Efectos de rosuvastatina sobre los medicamentos administrados conjuntamente.
Antagonistas de la vitamina K: como con otros inhibidores de la HMG-CoA reductasa, el inicio del tratamiento o la escalada de la dosis con rosuvastatina en pacientes tratados de forma concomitante con antagonistas de la vitamina K (p. ej.: warfarina u otros anticoagulantes cumarínicos) puede dar lugar a incrementos del Índice Normalizado Internacional (INR). La interrupción del tratamiento o la disminución de la dosis de rosuvastatina pueden resultar en una disminución del INR. En tales casos, es recomendable llevar a cabo una monitorización adecuada del INR.
Anticonceptivos orales/terapia hormonal sustitutiva (THS): la administración concomitante de rosuvastatina y un anticonceptivo oral originó un incremento del AUC de etinilestradiol y norgestrel del 26% y 34%, respectivamente. Deben tenerse en cuenta estos aumentos de los niveles plasmáticos a la hora de establecer la dosis del anticonceptivo oral. No hay datos farmacocinéticos disponibles de pacientes con tratamiento concomitante de rosuvastatina y THS y, por lo tanto, no se puede descartar un efecto similar.
Otros medicamentos:
Digoxina: De acuerdo a los resultados de estudios específicos de interacción no se esperan interacciones importantes con digoxina.
Ácido fusídico: el riesgo de miopatía incluyendo rabdomiólisis puede verse incrementado con la administración concomitante de ácido fusídico sistémico con estatinas. El mecanismo de esta interacción (tanto si es farmacodinámico, farmacocinético, o ambos) es todavía desconocido. Se han notificado casos de rabdomiólisis (incluyendo algunas fatalidades) en pacientes que reciben esta combinación. Si el tratamiento con ácido fusídico sistémico es necesario, el tratamiento con rosuvastatina debe interrumpirse durante el tratamiento con ácido fusídico.
Población pediátrica:
Solo se han realizado estudios de interacción en adultos. Se desconoce la magnitud de la interacción en la población pediátrica.
f. Fertilidad, embarazo y lactancia
Rosuvastatina está contraindicado durante el embarazo y la lactancia.
Las mujeres en edad fértil deben emplear medidas anticonceptivas adecuadas.
Debido a que el colesterol y otros productos de la biosíntesis del colesterol son esenciales para el desarrollo del feto, el riesgo potencial de la inhibición de la HMG-CoA reductasa sobrepasa las ventajas del tratamiento durante el embarazo. Los estudios en animales proporcionan una evidencia limitada de la toxicidad para la reproducción. Si una paciente queda embarazada durante el tratamiento con este medicamento, se debe interrumpir el tratamiento inmediatamente.
Rosuvastatina se excreta en la leche de ratas. No existen datos respecto a la excreción en la leche materna.
g. Efectos sobre la capacidad para conducir y utilizar máquinas
No se han llevado a cabo estudios para determinar el efecto de rosuvastatina sobre la capacidad de conducir o utilizar máquinas. Sin embargo, de acuerdo a sus propiedades farmacodinámicas, no es probable que rosuvastatina afecte esta capacidad. Cuando se conduzcan vehículos o se utilice maquinaria, debe tenerse en cuenta la posibilidad de mareos durante el tratamiento.
h. Reacciones adversas
Las reacciones adversas observadas con rosuvastatina son generalmente de carácter leve y transitorio. En ensayos clínicos controlados menos del 4% de los pacientes tratados con rosuvastatina abandonaron el estudio debido a las reacciones adversas.
Lista tabulada de reacciones adversas
Basándose en los datos de los estudios clínicos y en la amplia experiencia tras la comercialización, la tabla siguiente presenta el perfil de reacciones adversas de rosuvastatina. Las reacciones adversas enumeradas a continuación están clasificadas según su frecuencia y por órganos o sistemas (SOC).
Las reacciones adversas se han clasificado en función de su frecuencia según la convención:
Muy frecuentes (≥ 1/10)
Frecuentes (≥1/100 a <1/10)
Poco frecuentes (≥1/1.000 a <1/100)
Raros (≥1/10.000 a <1/1.000)
Muy raros (<1/10.000)
Frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Tabla 2. Reacciones adversas basadas en la información obtenida de estudios clínicos y la experiencia postcomercialización
| Tabla 2. Reacciones Adversas basadas en la información obtenida de estudios clínicos y la experiencia postcomercialización | |||||
| Órgano o Sistema | Frecuentes | Poco Frecuentes | Raras | Muy Raras | Frecuencia no conocida |
| Trastornos de la sangre y el sistema linfático | Trombocitopenia | ||||
| Trastornos del sistema inmunológico | Reacciones de hipersensibilidad incluyendo angioedema | ||||
| Trastornos endocrinos | Diabetes Mellitus | ||||
| Trastornos psiquiátricos | Depresión | ||||
| Trastornos del sistema nervioso | Cefalea, mareos | Polineuropatía, pérdida de memoria | Neuropatía periférica, alteraciones del sueño (incluyendo insomnio y pesadillas) | ||
| Trastornos respiratorios, torácicos y mediastínicos | Tos, disnea | ||||
| Trastornos gastrointestinales | Estreñimiento, náuseas, dolor abdominal | Pancreatitis | Diarrea | ||
| Trastornos hepatobiliares | Aumento de las transaminasas | Ictericia, hepatitis | |||
| Trastornos de la piel y del tejido subcutáneo | Prurito, exantema, urticaria | Síndrome de Stevens-Johnson | |||
| Trastornos musculoesqueléticos y del tejido conjuntivo | Mialgia | Miopatía (Incluida miositis), Rabdomiólisis | Artralgia | Alteraciones en los tendones a veces agravadas por rotura, miopatía necrotizante mediada por el sistema inmunitario | |
| Trastornos renales y urinarios | Hematuria | ||||
| Trastornos del aparato reproductor y de la mama | Ginecomastia | ||||
| Trastornos generales y alteraciones en el lugar de administración | Astenia | Edema | |||
| La frecuencia dependerá de la presencia u ausencia de factores de riesgo (glucemia en ayunas >/= 5,6 mmol/l, IMC > 30kg/m2, triglicéridos elevados, historia de hipertensión). | |||||
Como con otros inhibidores de la HMG-CoA reductasa, la incidencia de reacciones adversas al medicamento tiende a ser dosis-dependiente.
Efectos renales: se ha observado proteinuria, detectada mediante tira reactiva y principalmente de origen tubular, en pacientes tratados con rosuvastatina. Se observaron cambios en la proteinuria desde nada o trazas hasta un resultado ++ o superior en <1% de los pacientes en algún momento del tratamiento con 10 y 20 mg y aproximadamente en el 3% de los pacientes tratados con 40 mg. Con la dosis de 20 mg se observó un pequeño incremento en el cambio desde nada o trazas a +. En la mayoría de los casos, la proteinuria disminuye o desaparece de forma espontánea al continuar con el tratamiento, y no se ha demostrado que sea indicativa de enfermedad renal aguda o progresiva.
Se ha observado hematuria en pacientes tratados con rosuvastatina y los datos clínicos muestran que la frecuencia de aparición es baja.
Efectos sobre el músculo esquelético: se han registrado efectos sobre el músculo esquelético, p. ej.: mialgia, miopatía (incluyendo miositis) y, muy raramente, rabdomiólisis con o sin fallo renal agudo con todas las dosis, en pacientes tratados con todas las dosis de rosuvastatina y especialmente con dosis superiores a 20 mg.
Se ha observado un incremento dosis-dependiente de los niveles de CK en pacientes tratados con rosuvastatina, siendo la mayoría de los casos leves, asintomáticos y transitorios. Si los niveles de CK son elevados (>5xLSN), se debe interrumpir el tratamiento.
Efectos hepáticos: como con otros inhibidores de la HMG-CoA reductasa, se ha observado un incremento dosis-dependiente de las transaminasas en un reducido número de pacientes tratados con rosuvastatina; la mayoría de los casos fueron leves, asintomáticos y transitorios. Las siguientes reacciones adversas han sido registradas con algunas estatinas:
– Disfunción sexual.
– Casos excepcionales especialmente en tratamientos a largo plazo.
La frecuencia de notificaciones de rabdomiólisis, acontecimientos renales graves y acontecimientos hepáticos graves (que consisten principalmente en el aumento de las transaminasas hepáticas) es mayor con la dosis de 40 mg.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas.
i. Sobredosis
No existe un tratamiento específico en caso de sobredosis. Si se produce una sobredosis, debe tratarse al paciente sintomáticamente e instaurar medidas de soporte, según sea necesario. Deben monitorizarse la función hepática y los niveles de CK. No es probable que la hemodiálisis proporcione algún beneficio.
PROPIEDADES FARMACOLÓGICAS
a. Propiedades farmacodinámicas
Grupo farmacoterapéutico: agentes modificadores de los lípidos, monofármacos, inhibidores de la HMG-CoA reductasa.
Código ATC: C10A A07
Mecanismo de acción
Rosuvastatina es un inhibidor competitivo y selectivo de la HMG-CoA reductasa, la enzima limitante que convierte la 3-hidroxi-3-metilglutaril coenzima A en mevalonato, un precursor del colesterol. El principal lugar de acción de rosuvastatina es el hígado, el órgano diana para la disminución de los niveles de colesterol.
Rosuvastatina aumenta el número de receptores LDL hepáticos en la superficie celular, aumentando la absorción y el catabolismo de LDL e inhibe la síntesis hepática de VLDL, reduciendo así el número total de partículas VLDL y LDL.
Efectos farmacodinámicos
Rosuvastatina reduce los niveles elevados de colesterol-LDL, colesterol total y triglicéridos e incrementa el colesterol-HDL. También disminuye los valores de ApoB, C-noHDL, C-VLDL, TG-VLDL e incrementa los valores de ApoA1 (ver Tabla 3). Rosuvastatina también disminuye los cocientes de C-LDL/C-HDL, C-total/C-HDL, C-noHDL/C-HDL y ApoB/ApoA1.
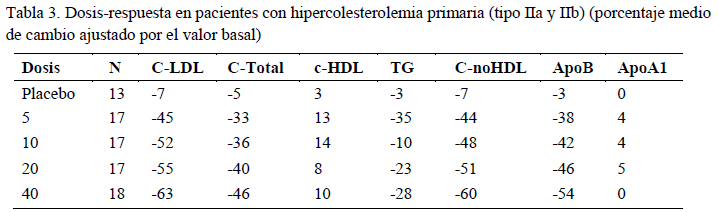
El efecto terapéutico se obtiene 1 semana después del inicio del tratamiento y el 90% de la respuesta máxima se alcanza a las 2 semanas. La respuesta máxima se alcanza generalmente a las 4 semanas de tratamiento y se mantiene a partir de ese momento.
Eficacia clínica y seguridad
Rosuvastatina es eficaz en pacientes adultos con hipercolesterolemia, con o sin hipertrigliceridemia, independientemente de la raza, sexo o edad, y en poblaciones especiales de pacientes tales como diabéticos o pacientes con hipercolesterolemia familiar.
b. Propiedades farmacocinéticas
Absorción: las concentraciones plasmáticas máximas de rosuvastatina se alcanzan aproximadamente 5 horas después de la administración oral. La biodisponibilidad absoluta es de aproximadamente un 20%.
Distribución: rosuvastatina es extensamente absorbida por el hígado, principal lugar de síntesis del colesterol y de aclaramiento del C-LDL. El volumen de distribución de rosuvastatina es de aproximadamente 134 l. Rosuvastatina se une a proteínas plasmáticas aproximadamente en un 90%, principalmente a la albúmina.
Biotransformación: rosuvastatina se metaboliza de forma limitada (aproximadamente un 10%). Estudios in vitro de metabolismo realizados en hepatocitos humanos indican que rosuvastatina no es un buen sustrato del metabolismo mediado por el citocromo P450. La principal isoenzima implicada es la CYP2C9, y en menor medida la 2C19, 3A4 y la 2D6. Los principales metabolitos identificados son el N-desmetilado y el lactónico. El metabolito N-desmetilado es aproximadamente un 50% menos activo que rosuvastatina, mientras que el lactónico se considera clínicamente inactivo. Más de un 90% de la actividad de inhibición de la HMG-Co A reductasa circulante se atribuye a rosuvastatina.
Eliminación: aproximadamente un 90% de rosuvastatina se excreta inalterada en las heces (incluyendo el principio activo absorbido y no absorbido) y el resto se excreta en orina. Aproximadamente el 5% se excreta inalterado en la orina. La semivida de eliminación plasmática es de aproximadamente 19 horas. La semivida de eliminación no aumenta al incrementar la dosis. La media geométrica del aclaramiento plasmático es aproximadamente 50 litros/hora (coeficiente de variación 21,7%). Como con otros inhibidores de la HMG-CoA reductasa, el transportador de membrana OATP-C está implicado en la absorción hepática de rosuvastatina. Este transportador es importante en la eliminación hepática de rosuvastatina.
Linealidad: la exposición sistémica a rosuvastatina aumenta de forma proporcional a la dosis. No hay cambios en los parámetros farmacocinéticos después de la administración de dosis diarias repetidas.
Poblaciones especiales:
Edad y sexo: la edad y el sexo no afectan de forma clínicamente significativa a la farmacocinética de rosuvastatina en adultos. La exposición en niños y adolescentes con hipercolesterolemia familiar heterocigótica parece ser similar o menor que en pacientes adultos con dislipidemia (ver “Población pediátrica” más adelante).
Polimorfismos genéticos: la disponibilidad de los inhibidores de la HMG-CoA reductasa, incluida rosuvastatina, implica a las proteínas transportadoras OATP1B1 y BCRP. En pacientes con polimorfismos genéticos SLCO1B1 (OATP1B1) o ABCG2 (BCRP) existe un riesgo de exposición aumentada a rosuvastatina. Los polimorfismos individuales de SLCO1B1 c.521CC y ABCG2 c.421AA se asocian con una mayor exposición (AUC) a rosuvastatina en comparación con los genotipos SLCO1B1 c.521TT o ABCG2 c.421CC. Este genotipado específico no está establecido en la práctica clínica, pero se recomienda una dosis diaria menor de rosuvastatina en pacientes que se sabe presentan estos tipos de polimorfismos.
DATOS FARMACÉUTICOS
a. Incompatibilidades
No procede.
b. Periodo de validez
3 años.
c. Precauciones especiales de conservación
Conservar a temperatura no mayor de 30°C
d. Naturaleza y contenido del envase
Blíster Aluminio-Aluminio con impresión.
Muestra Médica:
Caja con 2 y 4 tabletas.
Comercial:
Caja con 30 tabletas
Hospital:
Caja con 1000 Tabletas
e. Precauciones especiales de eliminación y otras manipulaciones
Ninguna especial.
TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
UNIPHARM S.A.
REVISIÓN DEL TEXTO
Junio-2018
REFERENCIAS BIBLIOGRÁFICAS
Agencia Española de Medicamentos AEMPS.
Portada