Forma Farmacéutica y Formulación
Forma Farmacéutica
Crema Tópica
Presentación
Cada 100 gramos contiene:
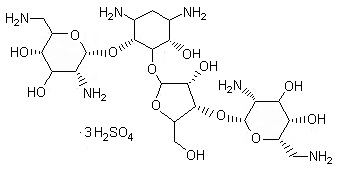
Neomicina Sulfato eq. A neomicina…500.00 mg
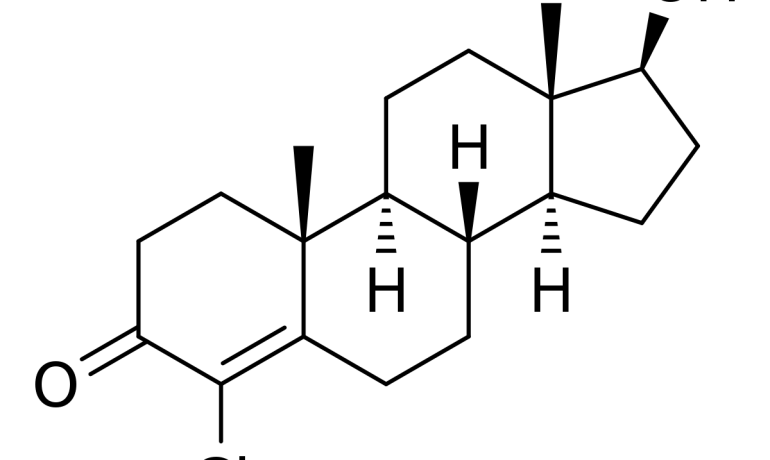
Clostebol Acetato eq. A clostebol…500.00 mg
Excipientes c.s.p.
DATOS CLINICOS
A. INDICACIONESTERAPÉUTICAS:
Neobol® Crema tópica está indicado en enfermedades de la piel y mucosas como:
infecciones en la piel, úlcera cutánea, quemaduras, heridas y dermatosis.
B. POSOLOGÍAY FORMA DE ADMINISTRACIÓN:
Posología
Aplicar una fina capa de crema sobre la lesión 1 ó 2 veces por día. La región puede cubrirse con una gasa estéril1.
Forma de administración
Vía de administración: Tópica.
C. CONTRAINDICACIONES:
Contraindicado en pacientes con hipersensibilidad2, 3 a neomicina sulfato, clostebol acetato y a cualquiera de los excipientes del producto.
D. ADVERTENCIASY PRECAUCIONES ESPECIALES DE EMPLEO:
Debe evitarse el uso continuo de Neobol® Crema tópica.
Debido al riesgo potencial de ototoxicidad y nefrotoxicidad de la neomicina, no se recomienda el uso prolongado del producto en superficies lesionadas extensas que puedan permitir la absorción de neomicina.
Evitar la aplicación en los ojos.
Población Pediátrica
El uso continuo de Neobol® Crema tópica debe evitarse; especialmente en la primera infancia.
Información importante sobre excipientes
Este medicamento puede causar reacciones locales en la piel (como dermatitis de contacto).
Este medicamento contiene sodio y potasio.
E. INTERACCIONES CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN:
El uso combinado de Neobol® Crema tópica con preparaciones tópicas que contienen otros antibióticos aminoglucósidos puede aumentar el riesgo de sensibilización o potenciar los efectos secundarios.
F. EMBARAZOY LACTANCIA
Durante el embarazo y la lactancia, el medicamento solo se debe administrar si realmente es necesario.
G. EFECTOSSOBRE LA CAPACIDAD DE CONDUCIR Y MANEJAR MAQUINARIA
La administración cutánea de Neobol® Crema tópica no afecta la capacidad para conducir y utilizar maquinaria.
H. REACCIONESADVERSAS
El uso, especialmente si es prolongado, del producto puede dar lugar a fenómenos de sensibilización.
Además, una aplicación prolongada durante varias semanas en áreas extensas de tejidos dañados podría dar lugar a la aparición de efectos sistémicos, como hipertricosis debido a una absorción masiva de clostebol.
A continuación se presentan las reacciones adversas descritas con este medicamento, clasificadas por órganos y sistemas y por categorías de frecuencia.
En su mayor parte fueron de naturaleza leve y en la zona de aplicación.
Las categorías de frecuencia utilizadas son: muy frecuentes (≥1/10), frecuentes (≥1/100,
<1/10), poco frecuentes (≥1/1000, <1/100), raras (≥1/10.000, <1/1000), muy raras (<1/10.000), incluyendo casos aislados.
| Reacciones adversas | Frecuencia | Descripción |
| Trastornos del sistema
inmunológico |
Muy raras | Hipersensibilidad. |
| Trastornos de la piel y del
tejido subcutáneo |
Muy raras | Irritación en la zona de
aplicación, alergia. |
| Trastornos generales y
alteraciones en el lugar de administración |
Poco frecuentes | Irritación en la zona de
aplicación. |
I. SOBREDOSIFICACIÓN
Una eventual sobredosis puede contemplarse solo en el caso de aplicaciones prolongadas y en áreas grandes de piel lesionada, lo que podría inducir efectos secundarios como sensibilización.
Tratamiento: Suspender el tratamiento.
PROPIEDADES FARMACOLÓGICAS
A. PROPIEDADES FARMACODINÁMICAS
Clasificación farmacológica y terapéutica: Andrógenos para uso tópico
Mecanismo de acción:
De los dos ingredientes activos de Neobol® Crema tópica, el acetato de clostebol, un derivado de la testosterona, ejerce un efecto de curación trófica y causa un marcado acortamiento del tiempo de reparación de las lesiones cutáneas y cutáneo-mucosas. Este efecto se debe a la propiedad común de todos los esteroides anabolizantes para activar los mecanismos bioquímicos celulares delegados a la síntesis de proteínas, es decir, la formación del material de construcción más importante del que dependen los procesos de granulación y reepitelización. El segundo componente de Neobol® Crema tópica, la neomicina, actúa indirectamente en el mismo proceso, favoreciendo la eliminación o previniendo la aparición de una infección local, que es notoriamente el factor más importante de retraso en la evolución de la cicatrización de las heridas.
B. PROPIEDADES FARMACOCINÉTICAS
Absorción
En vía tópica, el acetato de clostebol muestra muy poca absorción sistémica.
C. DATOSPRECLÍNICOS SOBRE SEGURIDAD
Las pruebas de toxicidad subaguda realizadas en conejos para aplicación local repetidas durante 15 días con una dosis de 1g/kg han excluido las variaciones en el peso corporal, el consumo de alimentos y agua, la diuresis, la urea en sangre y bilirrubinemia, así como el
peso de los órganos internos. La piel de los animales tratados presenta alteraciones locales de una cantidad significativamente menor en comparación con la tratada con los excipientes solos.
DATOS FARMACÉUTICOS
A. LISTADE EXCIPIENTES
- Emuldage (Mezcla de isopropil miristato, acido esteárico, cetil palmitato, ácido de coco, alcohol cetearilico, estearato de glicerilo, estearato de potasio, cocoato de potasio, estearato de sodio)
- Alcohol Bencílico
- Polisorbato 80 (Polioxietilen 20 sorbitan monooleato)
- Aromatizante de almendras
- Agua purificada
B. INCOMPATIBILIDADES
No procede
C. PERIODODE VALIDEZ
36 meses
D. PRECAUCIONESESPECIALES DE CONSERVACIÓN
Se debe conservar en condiciones de temperatura menor de 30ºC y alejado del calor excesivo.
E. NATURALEZA Y CONTENIDO DEL EMPAQUE
Lata de aluminio con tapa plástica blanca empacado en caja de cartón.
Presentaciones
- Muestra Médica: caja de cartón conteniendo una lata con 5 gramos.
- Farmacia: caja de cartón conteniendo una lata con 30 gramos.
REFERENCIAS BIBLIOGRAFICAS
1. AgenciaItaliana del Farmaco:
https://farmaci.agenziafarmaco.gov.it/bancadatifarmaci/home
2. Goodman& Gilman (2001). Las Bases Farmacológicas de la Terapéutica. 10a.
edición. McGRAW HILL INTERAMERICANA, México. Pág. 1252-1253.
3. Sweetman S. et al. (2002). Martindale, Guía Completa de consulta
Farmacoterapéutica. 33a. edicción. PHARMA EDITORES, Lodres, Gran Bretaña.
Pág. 347-348, 1492.
Revisión del texto: Septiembre 2018
Versión: 2