Forma Farmacéutica y Formulación
Forma Farmacéutica
Tableta Masticable
Composición Cualitativa y Cuantitativa
Cada Tableta Masticable contiene:
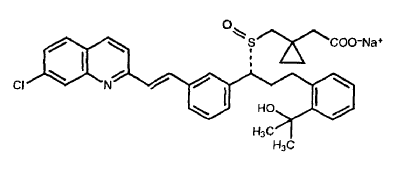
Montelukast sódico equivalente a Montelukast base….4 mg.
INDICACIONES TERAPEUTICAS
Montelukast es un antagonista de los receptores de leucotrienos indicado para:
- Montelukast está indicado en pacientes adultos y pediátricos de 6 meses de edad o mayores para la profilaxis y tratamiento crónico del asma, incluyendo la prevención de los síntomas diurnos y nocturnos, también para el tratamiento de pacientes asmáticos sensibles al ácido acetilsalicílico y para la prevención de la broncoconstricción inducida por ejercicio.
- Montelukast está indicado, para el alivio de los síntomas diurnos y nocturnos de la rinitis alérgica (rinitis alérgica estacional en adultos y pacientes pediátricos de 2 años de edad y mayores, y rinitis alérgica perenne en adultos y pacientes pediátricos de 6 meses de edad y mayores).
FARMACOCINÉTICA Y FARMACODINAMIA
Mecanismo de Acción: El montelukast inhibe la broncoconstricción debido a la acción del antígeno. El montelukast es un antagonista selectivo del receptor del cisteinil-leucotrieno (CysLT1) de los leucotrienos. Los cisteinil-leucotrienos (LTC4, LTD4, LTE4) son productos del metabolismo del ácido araquidónico que son liberados por varias células, incluyendo los mastocitos y los eosinófilos. Ellos se unen a los receptores cisteinil-leucotrieno (CysLT) que se encuentran en las vías aéreas del hombre. La unión de los cisteinil-leucotrieno los receptores de los leucotrienos se ha relacionado con la fisiopatología del asma, incluyendo el edema de las vías aéreas, contracción del músculo liso y la alteración de la actividad celular asociada con el proceso inflamatorio, todos estos factores que contribuyen a los signos y síntomas del asma. El montelukast tiene una afinidad muy alta y selectiva para unirse al receptor CysLT1, en comparación con otros receptores farmacológicamente importantes en las vías aéreas, como los receptores de los protanoides, colinérgicos o los beta- adrenergicos. El montelukast inhibe la acción fisiológica del LTD4 en los receptores CyasLT1, sin ninguna actividad agonista.
Farmacocinética: La concentración plasmática máxima Cmax de montelukast se alcanza entre 3 y 4 horas para una administración de 10 mg, de 2 a 2.5 horas para la administración de una tableta masticable de 5 mg y de 2 horas para la administración de una tableta masticable de 4 mg. Su absorción es rápida en el tracto gastrointestinal, con una biodisponibilidad media del 64%. La absorción en tabletas masticables es del 73% cuando se administra sin comidas. El montelukast se une a las proteínas plasmáticas en más de un 99%. Se metaboliza ampliamente en el hígado por las isoenzimas CYP3A4, CYP2A6 y CYP2C9 del citocromo P450 y se excreta principalmente por vía biliar, a través de las heces (86%). Su metabolismo disminuye y su semivida de eliminación aumenta en presencia de disfunción hepática moderada. Su tiempo de vida media t1/2 se encuentra entre 2.7 a 5.5 horas en adultos sanos, y su acción dura aproximadamente 24 horas.
La farmacocinética y biodisponibilidad oral del montelukast es similar en adultos jóvenes y geriátricos. La vida media es ligeramente mayor en pacientes ancianos, pero no debe hacerse un ajuste en la dosis.
CONTRAINDICACIONES
Embarazo, lactancia e Hipersensibilidad a cualquier componente de este producto.
Debe considerarse el riesgo-beneficio del uso de montelukast en pacientes con problemas hepáticos.
El metabolismo de montelukast se ve disminuido en pacientes con problemas de función hepática de leve a moderada y en pacientes con evidencia clínica de cirrosis; la vida media se ve liferamente aumentada (t1/2 de 7.4 hora); sin embargo no debe hacerse un ajuste en la dosis; montelukast no ha sido evaluada en pacientes con problemas de función hepática severa.
PRECAUCIONES Y ADVERTENCIAS DE SU USO
No debe utilizarse para tratar un ataque agudo de asma, advirtiendo a los pacientes que deben tener disponible un medicamento de rescate apropiado.
Los corticosteroides inhalados pueden ser reducidos gradualmente, no deben sustituirse abruptamente.
Se han reportado eventos adversos neuropsiquiátricos, por lo que se debe alertar a los pacientes de reportarlo a su médico.
Debe considerarse el riesgo-beneficio del uso de montelukast en pacientes con problemas hepáticos. El metabolismo del montelukast se ve disminuido en pacientes con problemas de función hepática de leve a moderada y en pacientes con evidencia clínica de cirrosis; la vida media se ve ligeramente aumentada (t1/2 de 7.4 horas); sin embargo, no debe hacerse un ajuste en la dosis; el montelukast no ha sido evaluado en pacientes con problemas de función hepática severa.
Estudios en niños de 2 a 14 años han encontrado un perfil similar de eficacia y seguridad que en población adulta. La farmacocinética y la biodisponibilidad oral de montelukast es similar en adultos jóvenes y geriátricos. La vida media es ligeramente mayor en pacientes ancianos. Pero no debe hacerse un ajuste en la dosis.
Si con el consumo de este medicamento se observa cambios de humor, agresividad, irritabilidad, alteraciones del sueño, depresión e ideación suicida, comunicarse directamente con el médico tratante.
Suviar 4mg contiene aspartame, este producto se metaboliza a fenilalanina y puede causar toxicidad.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE FERTILIDAD.
Se han desarrollado pocos estudios en humanos acerca de la carcinogenicidad y mutagenicidad del montelukast, sin embargo, no existe evidencia en animales que produzca ambos problemas con su administración. No se observó teratogenicidad en dosis de 400 y 300 mg/kg en ratas y conejos respectivamente. Se redujo la fertilidad en ratas hembras en dosis 70 veces mayores que la usada en adultos. No hubo ningún cambio en la fertilidad en dosis 20 veces mayores que la usada en adultos.
USO DURANTE EL EMBARAZO Y LACTANCIA
Estudios en animales han demostrado que el motelukast atraviesa la barrera placentaria y se distribuye en la leche materna, por lo que debe considerarse el riesgo de su uso durante el embarazo o lactancia. En la clasificación de la FDA sobre su riesgo en el embarazo el montelukast se encuentra en la categoría B.
ADVERTENCIAS
El uso de este medicamento puede ocasionar la presencia de eventos neuropsiquiatricos que incluyen casos de agitación, agresividad, ansiedad, alteraciones de sueño y alucinaciones, depresión, insomnio, irritabilidad, inquietud, pensamientos y conductas suicidas (incluido el suicidio) y temblor en niños, adolescentes y adultos. Los pacientes y profesionales de la salud deben considerar suspender su uso si los pacientes desarrollan estos síntomas. Los pacientes deben hablar con su médico si se producen estos
Este medicamento puede ser perjudicial para personas con fanilcetonuria porque contiene aspartame que es una fuente de fenilalanina. Puede producir un ligero efecto laxante porque contiene manitol.
REACCIONES ADVERSAS
Los posibles efectos adversos, descritos por el Committee on Safety of Medicines del RU tras ingerir montelukast después de las comidas fueron, dolor de cabeza edema, agitación, inquietud, alergia, incluida anafilaxia, angioedema y urticaria, dolor torácico, temblor, sequedad de boca, vértigo y artralgia. Posteriormente se describieron otros efectos adversos: pesadillas, sedación, palpitaciones y aumento de la sudoración.
Otros efectos adversos de menor frecuencia fueron: dolor abdominal o de estómago, astenia o fatiga (debilidad o cansancio inusual), tos, dolor dental, mareos, dispepsia, fiebre, gastroenterirtis, congestión nasal.
Algunos trastornos neuropsiquiátricos post-mercadeo han sido reportados en adultos, adolescentes y niños con el uso de montelukast. Estos incluyen agitación, comportamiento hostil y agresivo, ansiedad, depresión (incluyendo pensamientos y conducta suicida), desorientación, anormalidades del sueño, alucinaciones, irritabilidad y temor. Debe advertírseles a los pacientes de reportar estos efectos a su médico. La trombocitopenia puede ocurrir (signos y síntomas iniciales son tendencias de sangrado incluyendo epistaxis y menorragia gingival). Si se observan estos síntomas se debe interrumpir la administración de montelukast y tomar las medidas adecuadas.
Alteraciones hepáticas y renales: Aunque existen indicios de efectos hepáticos en pacientes que reciben montelukast (elevación de enzimas hepáticas), y a pesar de que sufre un elevado metabolismo hepático, el montelukast (a diferencia del zafirlukast) no se considera, contraindicado en pacientes con disfunción hepática leve o moderada, y no se considera necesario el reajuste de la dosis en caso de disfunción leve a moderada. En principio, no es necesario reajustar la dosis en pacientes de disfunción renal.
Síndrome de Churg-Strauss: Pacientes con asma en terapia con montelukast pueden presentar eosinofilia sistémica, algunas veces presentándose con características de vasculitis, consistentes con el síndrome de Churg-Strauss, una condición que es frecuentemente tratada con corticosteroides sistémicos. Estos eventos, pero no siempre, han sido asociados con la reducción de la terapia oral de corticosteroides.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO
Se recomienda la determinación de la concentración de montelukast cuando se administra junto con potentes inductores hepáticos, como fenitoína, fenobarbital o rifampicina.
Se ha observado una disminución del 40% del área bajo la curva AUC de montelukast cuando se administra conjuntamente con fenobarbital; sin embargo, se cree que la dosis de montelukast no debe reajustarse si se administra fenobarbital.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO
Los siguientes análisis de laboratorio se han visto alterados con la administración de montelukast: Alanina aminotransferasa, aspartato aminotransferasa. Eosinófilos: el valor medio de eosinófilos periféricos puede aumentarse por un 13-15% de su valor normal.
INFORMACIÓN GENERAL SOBRE SU ADMINISTRACIÓN
El montelukast es utilizado para prevenir ataques de asma. No es utilizado para tratar un ataque cuando este ya haya iniciado. Para tratar un ataque de asma que ya haya comenzado, debe utilizar otro medicamento. Si usted no tiene algún otro medicamento para ser utilizado en un ataque o tiene alguna pregunta sobre este tema, consúltelo con su médico.
Al iniciar un tratamiento con montelukast en pacientes que toman corticosteroides orales o inhalados, estos no se deben discontinuar abruptamente. Se pueden disminuir gradualmente, bajo supervisión médica. Raramente la reducción sistémica de coricosteroides en paciente o algún otro antagonista de los leucotrienos ha mostrado la aparición de eosinofilia, rash, vasculitis, empeoramiento de los síntomas pulmonares, complicaciones cardiacas y/o neuropatía, algunas veces con síndrome de Churg Strauss. La relación causal entre este fenómeno y los antagonistas de los receptores de los leocotrienos no se ha establecido y el problema no se ha mostrado en estudios clínicos de montelukast. Sin embargo, se debe tomar precaución y debe monitorearse cuando se va a reducir la dosis de un conticosteroide en pacientes que están reviviendo montelukast.
Montelukast no debe de utilizarse como monoterapia para el tratamiento y manejo del broncoespasmo inducido por el ejercicio. Los pacientes deben de instruirse para continuar con el régimen usual de beta-agonistas inhalados como profilaxis del broncoespasmo inducido por el ejercicio, y deben de mantener un beta-agonista inhalado de corta acción disponible como tratamiento de rescate. Para que el montelukast actúe bien, este debe de tomarse todos los días (sin suspender su administración) a la misma hora, aun cuando se observe mejoría en los síntomas del asma.
Si se está tomando cualquier otro medicamento concomitante para el tratamiento del asma, no debe de reducirse la dosis de ninguno de los dos medicamentos, aun cuando se observe mejoría de los síntomas del asma.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL
No se dispone de información específica sobre el tratamiento de sobredosis con montelukast. En estudios de asma crónica, montelukast se ha administrado a dosis de hasta 200 mg/día a pacientes adultos, durante 22 semanas y, en estudios a corto plazo, a dosis de hasta 900 mg/día a los pacientes, durante aproximadamente una semana, sin registrarse experiencias adversas clínicamente importantes. En caso de sobredosis, es razonable emplear las medidas coadyuvantes usuales; p. ej., extraer el material no absorbido del tracto gastrointestinal, emplear vigilancia clínica e instituir terapia coadyuvante, si es necesario. Se han recibido informes de sobredosis agudas en pacientes pediátricos, ocurridas después de la introducción al mercado y en estudios clínicos, con dosis de al menos 150 mg/día de montelukast. Los hallazgos clínicos y de laboratorio que se observaron correspondieron al perfil de seguridad en adultos y pacientes pediátricos mayores. No se comunicaron experiencias adversas en la mayoría de los informes de sobredosis. Las experiencias adversas observadas con mayor frecuencia fueron sed, somnolencia, midriasis, hipercinesia (movimiento excesivo, actividad muscular exagerada) y dolor abdominal. No se sabe si montelukast puede extraerse por diálisis peritoneal o hemodiálisis.
DOSIS Y VÍA DE ADMINISTRACIÓN
Vía de administración: oral
Las tabletas masticables se recomiendan para su uso en niños de 2-15 años de edad y las tabletas recubiertas se recomiendan para su uso en adolescentes y adultos mayores de 15 años,
Dosis Usual en adolescentes y adultos: (tabletas recubiertas)
Asma bronquial crónica o rinitis alérgica (intermitente o persistente), o broncoconstricción inducida por ejercicio: 10 mg una vez al día por la tarde.
Dosis pediátrica usual: (tabletas masticables)
Asma bronquial crónica o rinitis alérgica (intermitente o persistente):
Niños 2 a 5 años: 4 mg al día por la tarde.
Niños de 6 a 15 años: 5 mg al día por la tarde.
CONDICIONES DE ALMACENAMIENTO
Almacenar a temperatura menor de 30⁰C y alejado del calor excesivo en su envase
PRESENTACIONES
SUVIAR 4 mg TABLETAS MASTICABLES
FARMACIA:
Caja plegadiza x 10 tabletas masticables en blíster de PVC-PVDC blanco / aluminio
Caja plegadiza x 30 tabletas masticables en blíster de PVC-PVDC blanco / aluminio
MUESTRA MÉDICA:
Caja plegadiza x 5 tabletas masticables en blíster de PVC-PVDC blanco / aluminio
Caja plegadiza x 2 tabletas masticables en blíster de PVC-PVDC blanco / aluminio
REFERENCIAS BIBLIOGRÁFICAS
- USP DI. Drug Information for the Health Care Professional. 23rd 2003. Thomson Micomedex. United States of America. Pp. 1945-1947
- Guía Completa de Consulta Farmacoterapéutica. 1ª Edición. Pharma Editores, S.L. Barcelona 2003. pp 885, 902.
Revisión Dic. 2016