Forma Farmacéutica y Formulación
Forma Farmacéutica
Tabletas
Composición Cualitativa:
Cada tableta contiene:
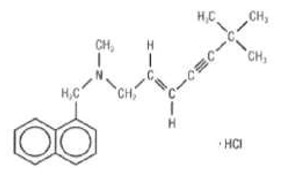
Terbinafina clorhidrato eq. a terbinafina…250 mg
Excipientes c.s.p.
Contiene almidón procedente de la papa
PROPIEDADES FARMACOLÓGICAS
a. Propiedades farmacodinámicas:
La terbinafina es una alilamina que presenta un amplio espectro de actividad frente a agentes patógenos fúngicos de la piel, pelo y uñas, incluidos dermatofitos tales como Trichophyton (p. ej. rubrum, T. mentagrophytes, T. verrucosum, T. tonsurans, T. violaceum), Microsporum (p. ej. M. canis) y Epidermophyton floccosum. A concentraciones bajas, la terbinafina es fungicida frente a dermatofitos, mohos y algunos hongos dimórficos. La actividad frente a levaduras es fungicida (p. ej. Pityrosporum orbiculare o Malassezia furfur) o fungistática, según las especies. La terbinafina interfiere de modo específico en el primer paso de la biosíntesis del esterol fúngico.
b. Propiedades farmacocinéticas:
La terbinafina se absorbe bien (>70%) y su biodisponibilidad absoluta, tras el metabolismo de primer paso, es del 50% aproximadamente. Una dosis oral única de 250 mg de terbinafina produce concentraciones plasmáticas máximas medias de 814 a 1340 microgramos/L durante las 2 horas siguientes a la administración. Las concentraciones plasmáticas de terbinafina descienden de manera trifásica, con una semivida efectiva de 30 horas aproximadamente.
La biodisponibilidad de terbinafina se ve ligeramente afectada por la comida, pero no lo suficiente como para requerir ajustes en la dosis. La terbinafina tiene una unión a proteínas plasmáticas del 99%. Se distribuye ampliamente a los tejidos y se concentra en la piel (incluido el estrato córneo) y el tejido adiposo (folículos pilosos y pieles ricas en grasa). La terbinafina se distribuye en la placa de la uña durante las primeras semanas de haberse iniciado la terapia. La biotransformación produce metabolitos sin actividad antifúngica que se excretan fundamentalmente con la orina (70% aproximadamente). El resto de la dosis se excreta en heces.
Estudios de farmacocinética de dosis única en pacientes con insuficiencia renal (aclaramiento de creatinina < 50 ml/min) o disfunción hepática preexistente han mostrado que el aclaramiento de terbinafina puede reducirse en un 50% aproximadamente.
DATOS CLÍNICOS
a. INDICACIONES TERAPÉUTICAS:
Está indicado en el tratamiento de las siguientes infecciones fúngicas de la piel, cuero cabelludo y uñas: Tinea corporis, Tinea cruris, Tinea pedis, Tinea capitis, Onicomicosis.
En el tratamiento de la Tinea corporis, Tinea cruris, Tinea pedis, la vía oral se considerará adecuada dependiendo del lugar, gravedad o extensión de la infección.
b. POSOLOGÍA Y FORMA DE ADMINISTRACIÓN:
Dosis recomendada
Adultos: 250 mg (1 comprimido) una vez al día.
Duración del tratamiento: La duración del tratamiento varía en función de la indicación y gravedad de la infección.
| INFECCIONES EN LA PIEL | |
| Tinea pedis (Interdigital, plantar/tipo mocasín) | 2-6 semanas |
| Tinea corporis | 4 semanas |
| Tinea cruris | 2-4 semanas |
| INFECCIONES DEL PELO Y DEL CUERO CABELLUDO | |
| Tinea capitis | 4 semanas |
| ONICOMICOSIS | Para la mayoría de los pacientes, es de 6-12 semanas |
|
Onicomicosis en las uñas de las manos |
6 semanas |
|
Onicomicosis en las uñas de los pies |
12 semanas (los pacientes con escaso crecimiento de la uña pueden requerir tratamientos más largos) |
El efecto clínico óptimo se observa varios meses después de la curación micótica y cese del tratamiento. Esto está ligado al periodo necesario para el crecimiento del tejido sano de la uña.
c. CONTRAINDICACIONES:
Hipersensibilidad al principio activo o a alguno de los excipientes, insuficiencia renal grave, insuficiencia hepática
d. ADVERTENCIAS Y PRECAUCIONES ESPECIALES DE EMPLEO:
Función hepática: No se recomienda el uso en pacientes con disfunción hepática crónica o activa. Antes de prescribir deben realizarse pruebas de valoración de la función hepática. Puede producirse hepatotoxicidad en pacientes con y sin disfunción hepática preexistente, por lo que se recomienda realizar controles periódicos (tras 4-6 semanas de tratamiento) de la función hepática.
En el caso de incrementos en los resultados del test de la función hepática, se debe interrumpir de inmediato el tratamiento.
Efectos dermatológicos: Casos muy raros de reacciones graves de la piel (p.ej. Síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, erupción medicamentosa con eosinofilia y síntomas sistémicos). Si se produce erupción cutánea progresiva, debe interrumpirse el tratamiento. La terbinafina se debe utilizar con precaución en pacientes con psoriasis o con lupus eritematoso preexistentes.
Efectos hematológicos: Casos muy raros de discrasias sanguíneas (neutropenia, agranulocitosis, trombocitopenia, pancitopenia) en pacientes. Debe evaluarse la etiología de cualquier discrasia sanguínea que se produzca en los pacientes tratados y considerar la necesidad de un posible cambio en el régimen de la medicación, incluyendo la interrupción del tratamiento.
Función renal: En pacientes con insuficiencia renal no se recomienda su uso.
e. INTERACCIONES CON OTROS MEDICAMENTOS:
El aclaramiento plasmático de la terbinafina puede ser acelerado por aquellos fármacos que inducen el metabolismo y puede ser inhibido por fármacos que inhiban el citocromo P-450. Cuando sea necesaria la administración concomitante de estos fármacos, puede ser necesario ajustar la dosis.
La cimetidina disminuye el aclaramiento de terbinafina en un 33%. Debido a la inhibición de las enzimas CYP2C9 y CYP3A4, el fluconazol incrementa la concentración máxima (Cmax) y el AUC de la terbinafina en un 52% y 69% respectivamente. Se puede producir un incremento similar en la exposición con otros fármacos que inhiben las enzimas CYP2C9 y CYP3A4, como son el ketoconazol y la amiodarona.
La rifampicina incrementa el aclaramiento de terbinafina en un 100%. La terbinafina disminuyó el aclaramiento de la cafeína administrada por vía intravenosa en un 19%. La terbinafina incrementó el aclaramiento de la ciclosporina en un 15%.
f. EMBARAZO Y LACTANCIA:
Embarazo: no se han observado casos de malformaciones en humanos con terbinafina. A pesar de ello, no se debe utilizar durante el embarazo, a no ser que la situación clínica de la mujer requiera tratamiento con terbinafina oral y los beneficios esperados para la madre sean mayores que los posibles riesgos para el feto.
Lactancia: La terbinafina se excreta en la leche materna; por consiguiente, las madres que estén en tratamiento oral no deben dar el pecho.
g. EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y MANEJAR MAQUINARIA:
Los pacientes que experimenten mareos como una reacción adversa deben evitar conducir vehículos y utilizar máquinas.
h. REACCIONES ADVERSAS:
Las reacciones adversas se listan con un sistema MedDRA de clasificación de órganos. Dentro de cada clase de órgano, las reacciones adversas se clasifican por frecuencia, nombrando las reacciones más frecuentes en primer lugar. Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
Además, la categoría de frecuencia correspondiente a cada reacción adversa se basa en la siguiente convención (CIOMS III): muy frecuentes (≥1/10); frecuentes (≥1/100 a <1/10); poco frecuentes (≥1/1.000 a <1/100); raras (≥1/10.000 a <1/1.000); muy raras (<1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
| Trastornos de la sangre y del sistema linfático | |
| Poco frecuentes | Anemia |
| Muy raras | Neutropenia, agranulocitosis, trombocitopenia, pancitopenia |
| Trastornos del sistema inmunológico | |
| Muy raras: | Reacción anafilactoide, angioedema, lupus eritematoso sistémico y cutáneo. |
| Frecuencia no conocida: | Reacciones anafilácticas, reacción semejante a la enfermedad del suero. |
| Trastornos psiquiátricos | |
| Frecuentes: | Depresión |
| Poco frecuentes | Ansiedad |
| Trastornos en el sistema nerviosos | |
| Muy frecuentes: | Cefalea. |
| Frecuentes: | Hipogeusia*, ageusia*, mareo |
| Poco frecuentes: | Parestesia e hipoestesia. |
| Frecuencia no conocida: | Anosmia incluyendo anosmia permanente, hiposmia. |
| Trastornos oculares | |
| Frecuentes: | Alteración visual. |
| Frecuencia no conocida: | Visión borrosa, disminución de la agudeza visual. |
| Trastornos del oído y del laberinto | |
| Poco frecuentes: | Tinitus. |
| Frecuencia no conocida: | Hipoacusia, pérdida de la audición. |
| Trastornos vasculares | |
| Frecuencia no conocida: | Vasculitis |
| Trastornos gastrointestinales | |
| Muy frecuentes: | Distensión abdominal, pérdida de apetito, dispepsia, náuseas, dolor abdominal, diarrea. |
| Frecuencia no conocida: | Pancreatitis |
| Trastornos hepatobiliares | |
| Raras: | Insuficiencia hepática, hepatitis, ictericia, colestasis, aumento de las enzimas hepáticas |
| Trastornos de la piel y del tejido subcutáneo | |
| Muy frecuentes: | Erupción, urticaria |
| Poco frecuentes: | Reacción de fotosensibilidad |
| Muy raras: |
Eritema multiforme, Síndrome de Stevens- Johnson, necrólisis epidérmica tóxica, pustulosis exantematosa generalizada aguda, erupción cutánea tóxica, dermatitis exfoliativa, dermatitis bullosa. Erupciones psoriasiformes o exacerbación del psoriasis. Alopecia |
| Frecuencia no conocida: | Erupción medicamentosa con eosinofilia y síntomas sistémicos. |
| Trastornos musculoesqueléticos y del tejido conjuntivo | |
| Muy frecuentes: | Artralgia, mialgia |
| Frecuencia no conocida: | Rabdomiólisis |
| Trastornos generales y alteraciones en el lugar de administración | |
| Frecuentes: | Fatiga |
| Poco frecuentes: | Pirexia |
| Frecuencia no conocida: | Enfermedad pseudo-gripal. |
| Exploraciones complementarias | |
| Poco frecuentes: | Pérdida de peso** |
| Frecuencia no conocida: | Aumento de la creatinfosfoquinasa en sangre. |
* Hipogeusia, incluyendo ageusia, que se recupera generalmente a las pocas semanas de la interrupción del tratamiento. Se han notificado casos aislados de hipogeusia prolongada.
**Pérdida de peso secundaria a hipogeusia.
i. SOBREDOSIFICACIÓN:
Después de la ingesta de hasta 5 g produce cefalea, náuseas, dolor en la parte superior del abdomen y mareo. El tratamiento recomendado para la sobredosificación consiste en eliminar el fármaco principalmente por administración de carbón activado y, en caso necesario, proporcionar un tratamiento de apoyo sintomático adecuado.
DATOS FARMACÉUTICOS
a. Lista de excipientes:
Polivinilpirrolidona
Almidón glicolato de sodio * Estearato de magnesio Croscarmelosa sódica Celulosa microcristalina Polisorbato 80
*Contiene almidón procedente de la papa
b. Incompatibilidades:
Ninguna
c. Periodo de validez:
2 años
d. Precauciones especiales de conservación:
Almacenar a temperatura no mayor de 30°C.
e. Naturaleza y contenido del envase:
Comercial:
Caja individual x 10 tabletas
Caja individual x 30 tabletas
Muestra médica:
Caja individual por 2 tabletas
FECHA DE REVISIÓN
Septiembre – 2018
REFERENCIAS BIBLIOGRAFICAS
- Agencia Española de AEMPS. Recopilado de: https://www.aemps.gob.es/cima/publico/lista.html