Forma Farmacéutica y Formulación
Forma Farmacéutica
Suspensión Oral
Composición Cualitativa y Cuantitativa
Cada 5 mL contiene:
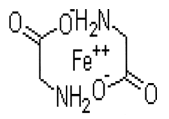
Hierro aminoquelado equivalente a hierro elemental…30.0 mg
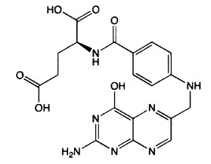
Ácido fólico…25.0 mg
Vehículo c.s.p.
Este medicamento contiene propilenglicol. Puede producir síntomas parecidos a los del alcohol, por lo que puede disminuir la capacidad de conducir o manejar maquinaria. Este medicamento contiene sorbitol los pacientes con intolerancia hereditaria a la fructosa no deben tomar este medicamento.
DATOS CLÍNICOS
a. ACCIONES TERAPÉUTICA:
El hierro es un componente esencial del organismo y es necesario para la formación de hemoglobina y para los procesos oxidativos de los tejidos vivos. La deficiencia de hierro o ferropenia, es la causa más frecuente de anemia nutricional en seres humanos. Las anemias ferropenicas responden rápidamente al tratamiento con hierro, aunque es preciso determinar y tratar la causa subyacente del proceso. Para la administración de hierro la vía de elección es oral. El hierro se administra oralmente a los niños para tratar y prevenir la deficiencia de hierro (anemia).
El ácido fólico es un miembro del grupo de la vitamina B, es necesario para varios procesos metabólicos. Su deficiencia produce anemia megaloblástica, en donde la administración de ácido fólico produce una remisión del cuadro hematológico, con su respuesta reticulocitaria, aumento de los eritrocitos, hemoglobina y desaparición de la hiperplasia megaloblástica de la médula ósea.
b. INDICACIONES Y USO CLÍNICO:
Esta indicado en la profilaxis y tratamiento de la anemia por deficiencia de hierro y ácido fólico en infantes, niños, adolescentes, adultos, mujeres embarazadas y ancianos. El hierro y las sales de hierro solo se administrarán para el tratamiento o la profilaxis de la anemia ferropénica. No deben administrarse para el tratamiento de otros tipos de anemia excepto cuando también este presenta una anemia ferropénica.
c. DOSIS Y ADMINISTRACIÓN:
Vía de administración: oral
Dosis: Niños menores de 6 años: ½ cucharadita (2.5mL) de suspensión al día.
Niños mayores de 6 años y adultos: 1 cucharadita (5mL) al día. Tratamiento 6 – 8 semanas.
d. CONTRAINDICACIONES Y ADVERTENCIAS:
En casos de anemia perniciosa, en casos raros de hipersensibilidad al ácido fólico, en casos de hipersensibilidad al hierro. El hierro aminoquelado debe emplearse con precaución y no debe emplearse combinado con tratamientos con hierro parenteral. También está contraindicado en casos de úlcera duodenal, carcinoma del estómago, o colitis ulcerosa. En anemia perniciosa. Evitar una sobredosis por peligro de intoxicación agua del hierro. Los preparados a base de hierro no deben administrarse a pacientes que reciben transfusiones repetidas de sangre o a pacientes con anemias que no se deban a una deficiencia de hierro a menos que también este presenta una ferropenia. Se requiere precaución en pacientes con enfermedades de almacenamiento de hierro.
Intrafer TF-500 suspensión oral, Intrafer TF Pediátrico 8.55 mg/mL Suspensión oral/ Gotas pediátricas, Intrafer Suspensión oral contienen propilenglicol. Puede producir síntomas parecidos a los del alcohol, por lo que puede disminuir la capacidad de conducir o manejar maquinaria. Este medicamento contiene sorbitol. Los pacientes con intolerancia hereditaria a la fructosa no deben tomar este medicamento.
Intrafer® Tableta recubierta este medicamento contiene lactosa. Los pacientes con intolerancia hereditaria a galactosa, insuficiencia de lactasa de Lapp o malabsorción de glucosa o galactosa no deben tomar este medicamento. Tener en cuenta en el tratamiento de los pacientes con diabetes mellitus
e. PRECAUCIONES EN EL USO:
Dada su alta biodisponibilidad se utiliza con mucha rapidez. Por esta razón, una vez alcanzados niveles de ferritina sérica de 20 µg/L o más, se recomienda continuar el tratamiento solo con dosis de mantenimiento 1 gota/kg/día. En todo caso, este tipo de medicamento debe mantenerse fuera del alcance de los niños. El hierro aminoquelado no mancha los dientes, pero si esto sucediera basta con una buena higiene dental. La administración de hierro por más de 6 meses se debe evitar, excepto en pacientes con sangrado continuo, menorragia o embarazos repetidos.
Una ingesta masiva de este producto puede resultar en intoxicación peligrosa, por lo que debe mantenerse fuera del alcance de los niños. No debe administrarse junto con tiroxina y metildopa ya que el hierro disminuye la absorción de estos.
f. INTERACCIONES MEDICAMENTOSAS
La administración de antiácidos o ligantes de fosfato que contienen aluminio con preparaciones orales de hierro puede decrecer la absorción de hierro. La administración oral de la preparación de hierro inhibe la absorción de tetraciclinas del tracto GI y viceversa. Llevando al a disminución de concentración sérica de ambos, el antibiótico y el hierro, los pacientes deben recibir la tetraciclina 3 horas después o 2 horas antes de la administración oral de hierro.
Las sales de hierro pueden interferir en la absorción de tetraciclinas, zinc, fluoroquinolonas, levodopa, metildopa, penicilina y hormonas tiroideas. Los antihistamínicos H2 y la cafeína pueden interferir con la absorción de las sales ferrosas. Aunque esto no se ha demostrado con el hierro aminoquelado se recomienda como acción precautoria, que si se requiere de ambos tratamientos, que intrafer® Suspensión sea administrado dos horas antes o después de su administración.
g. REACCIONES ADVERSAS:
Las dosis terapéuticas de hierro pueden causar malestar gastrointestinal, constipación, diarrea y vómitos. Sin embargo, estudios con hierro aminoquelado han demostrado que la frecuencia e intensidad de estos trastornos es prácticamente nula, con excepción de oscurecimiento de las heces. No se han encontrado efectos secundarios con el ácido fólico.
h. SOBREDOSIFICACIÓN Y TRATAMIENTO:
En general, dosis grandes de hierro pueden tener efectos corrosivos e irritantes sobre la mucosa gastrointestinal llegando a producir necrosis y perforación. En estas condiciones se observa dolor epigástrico, diarrea y vómitos, seguidos algunas veces de fallo circulatorio cuando la hemorragia y la diarrea son muy severas. Horas o días después puede ocurrir acidosis metabólica, convulsiones y coma.
El tratamiento por intoxicación aguda consiste en la administración de eméticos, lavado gástrico, administración de drogas antidiarréicas y principalmente, administración de deferoxamina por sonda gástrica y por vía intravenosa. Si existe choque se efectuará transfusión sanguínea y administración de líquidos y electrolitos.
La valoración de niños que se piensa han ingerido hierro, pueden efectuarse una prueba de color para su detección en el contenido gástrico y una cuantificación urgente de la concentración plasmática del metal. Si esta última es de menos de 63µM (3.5mg/L), el niño no estará en peligro inmediato. No obstante, se deberá inducir el vómito cuando haya hierro en el estómago.
PROPIEDADES FARMACOLÓGICAS
FARMACOCINÉTICA:
El hierro se absorbe de modo irregular e incompleto en el tubo digestivo, siendo los principales lugares de absorción el duodeno y el yeyuno. La absorción aumenta con la secreción acido del estómago y algunos ácidos dietéticos (como el ácido ascórbico). La absorción también aumenta en situaciones de deficiencia de hierro o en ayunas, pero disminuye si los depósitos corporales están sobrecargados. Normalmente solo se absorbe alrededor del 5-15% de hierro ingerido en los alimentos. Después de la absorción, la mayor parte del hierro se une a la transferrina y es transportado hasta la medula ósea donde se incorpora a la hemoglobina, el resto se encuentra almacenado en forma de ferritina. Solo se excretan cantidades muy pequeñas de hierro. Excreción diaria de hierro en hombres sanos equivale sólo a 0.5 – 2 mg. La excreción ocurre principalmente a través de heces y como descamación de células tales como piel, mucosa gastrointestinal, uñas, pelo, solo trazas de hierro se excretan por la bilis y el sudor.
El ácido fólico se absorbe perfectamente cuando se administra por vía bucal, pero, está alterada en las diarreas y sobre todo en los síndromes de malabsorción, en que son necesarias dosis algo elevadas. Una vez absorbido, el ácido fólico pasa a la sangre, y su nivel en el suero se eleva normalizándose en el caso de anemia megaloblástica. El ácido fólico pasa a la leche materna, pudiendo ser activo en el niño que lacta. La excreción principal se efectúa por el riñón en forma de ácido fólico y sus metabolitos activos; dicha excreción corresponde al 5 a 90% de la dosis administrada (promedio 50% según la misma) a mayor dosis, mayor excreción y según el grado de carencia existente; dicha excreción se efectúa prácticamente en 24 horas.
DATOS FARMACÉUTICOS
a. Lista de excipientes:
- Metilparabeno
- Propilparabeno
- Citraro de sodio dihidratado
- Ácido cítrico anhidro
- Sacarina sódica
- Propilenglicol
- Pilietilenglicol
- Sorbitol 70%
- Sabor menta
- Alcohol etílico
- Agua purificada
b. Periodo de validez:
3 años
Precauciones especiales de conservación:
Almacenar a temperatura no mayor de 30 °C.
d. Naturaleza y contenido del envase:
Farmacia:
Caja con un frasco de 150 mL
Muestra médica:
Caja con un frasco de 60 mL
Hospitalaria:
Caja con 96 frascos de 150 mL
FECHA DE REVISIÓN
Noviembre 2017
REFERENCIAS BIBLIOGRAFICAS
- Martindale. The Extra Pharmacopeia. 28 edition. London: The Pharmaceutical 1982. Press. Pp. 872-874.
- Goodman & Gilman. Bases Farmacológicas de la Terapéutica. 8a edition. 1990. México: Interamericana. Pp. 1244-1250.
- PDR Genetics. First edition. Medical Economics Company Inc. Montalvale, New Jersey. 1995
- Litter, Manuel. Farmacología. Experimental y Clínica. 7a. edición. Argentina: El Ateneo. 1988. Pp. 1255-1257, 1308-1318.
- Goodman & Gilman. Bases Farmacológicas de la Terapéutica. 10. edición. 2003. México: Mc Graw-Hill Interamericana. Pp. 1510, 1517.
- Martindale. The Extra Pharmacopeia. 1ra. edición. 1883. London: Royal Pharmaceutical Society. Pp. 1568-1570.
- American Society of Health-System Pharmacists. AHFS Drug Information. 2015 edition. 2015. U.S.: American Society of Health-System Pharmacists. Pp. 1452, 1454.
- Martindale. The complete drug reference. 38th edition. 2014. London: Royal Pharmaceutical Society. Pp. 2073.
- Resolución 609 septiembre 2017, Republica de Panamá, Ministerio de Salud.